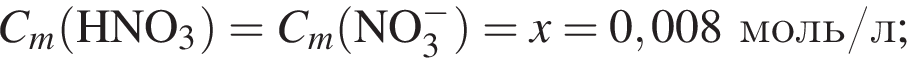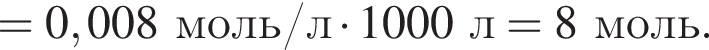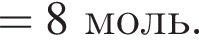Катионом является частица, формула которой:
Число нейтронов в составе атома ![]() равно:
равно:
Трёхзарядный катион (Э3+) имеет конфигурацию 1s22s22р5. Укажите число неспаренных электронов в атоме элемента Э в основном состоянии:
Согласно положению в периодической системе наибольшее значение электроотрицательности имеет химический элемент с порядковым номером:
Пользуясь справочными материалами, предложенными в сборнике тестов, НЕВОЗМОЖНО вычислить молярную массу:
Атомную кристаллическую решетку в твердом агрегатном состоянии образует:
Количество (моль) анионов, содержащихся в 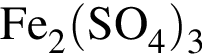 массой 312г, равно:
массой 312г, равно:
С помощью прибора, показанного на рисунке, методом вытеснения воды с наименьшими потерями можно собирать газ:
Фенолфталеин приобретает малиновую окраску в растворе, который образуется при растворении в воде оксида:
Кислотный оксид образуется при взаимодействии кислорода с веществом:
Масса твердого остатка будет наибольшей при термическом разложении соли химическим количеством 1 моль, формула которой:
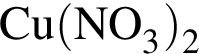
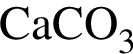
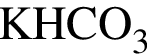
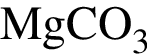
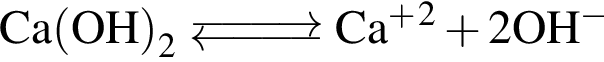
Укажите утверждение, верно характеризующее соль 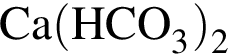 :
:
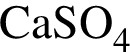
Укажите верное утверждение:
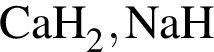 степень окисления водорода равна +1
степень окисления водорода равна +1Фтор в отличие от хлора:
а) НЕ образует оксиды
б) является газом (н. у.)
в) НЕ может иметь валентность равную V
г) НЕ реагирует со стеклом
Число веществ из предложенных — 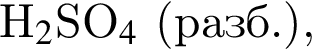

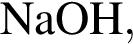

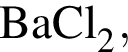 которые реагируют (20 °С) с раствором сульфата калия, равно:
которые реагируют (20 °С) с раствором сульфата калия, равно:
Исходные концентрации веществ C и B, участвующих в одностадийной реакции C+B=D, равны соответственно 1,5 моль/дм3 и 2,47 моль/дм3. Через минуту после начала реакции концентрация вещества C снизилась до 0,75 моль/дм3. Средняя скорость (моль/дм3 · с) данной реакции и концентрация вещества B (моль/дм3) через минуту после начала реакции равны соответственно:
Избыток газа, полученного действием серной кислоты на известняк, пропускают в стакан с известковой водой. При этом в стакане:
Выберите правильное утверждение:
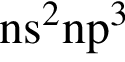
Массовая доля металла в оксиде ![]() равна 71,43%. Для этого металла справедливо утверждение:
равна 71,43%. Для этого металла справедливо утверждение:
К раствору серной кислоты добавили алюминий массой 9г. В результате реакции массовая доля кислоты в растворе снизилась от 28% до 21%. Масса (г) исходного раствора:
В закрытом сосуде постоянного объёма установилось равновесие

Затем температуру повысили. Для новой равновесной системы по сравнению с первоначальной верными являются утверждения:
а) давление в системе увеличилось
б) образовался водород количеством вдвое меньшим, чем израсходовалось иодоводорода
в) количество водорода НЕ изменилось
г) количество йода уменьшилось
В насыщенном растворе массовая доля соли равна 10 %. Укажите растворимость соли в граммах на 100 г воды:
Число возможных попарных взаимодействий в разбавленном водном растворе между ионами 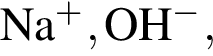
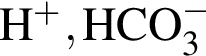 равно:
равно:
Значение pH уменьшится при:
К увеличению ![]() водного раствора приведет:
водного раствора приведет:
При добавлении к воде оксида кальция:
а) рН увеличивается;
б) рН уменьшается;
в) концентрация ионов ![]() НЕ изменяется;
НЕ изменяется;
г) концентрация ионов ![]() уменьшается.
уменьшается.
Укажите формулу соединения, которое вступает в реакции поликонденсации:
Для превращения 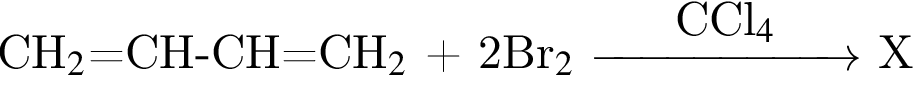 верно:
верно:
Установите соответствие между названием органического вещества и общей формулой гомологического ряда, к которому относится данное вещество.
А) бутадиен-1,3
Б) пропаналь
В) пропанол-2
Г) бутин-1
1) 
2) 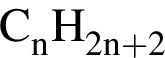
3) 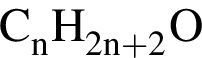
4) 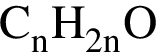
5) 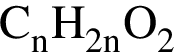
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А2Б2В5Г1.
Выберите утверждения, справедливые для этанола:
1) является гомологом вещества, формула которого
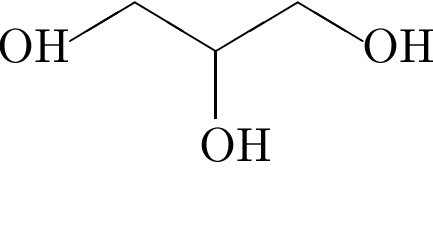
2) является первичным спиртом
3) при нагревании с концентрированной серной кислотой может быть получен этилен
4) при взаимодействии с уксусной кислотой в присутствии серной кислоты образует соединение, формула которого
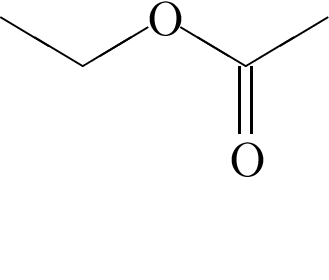
5) кислотные свойства выражены сильнее, чем у фенола
6) получается при взаимодействии этилена с кислородом в присутствии хлоридов палладия и меди
Ответ запишите в виде последовательности цифр в порядке возрастания, например: 135.
Алкин массой 63,67 г полностью сожгли в избытке кислорода. Образовавшийся углекислый газ смешали с гелием объемом (н. у.) 56,00 дм3. Молярная масса полученной при этом смеси газов составила 30,00 г/моль. Определите молярную массу (г/моль) алкина.
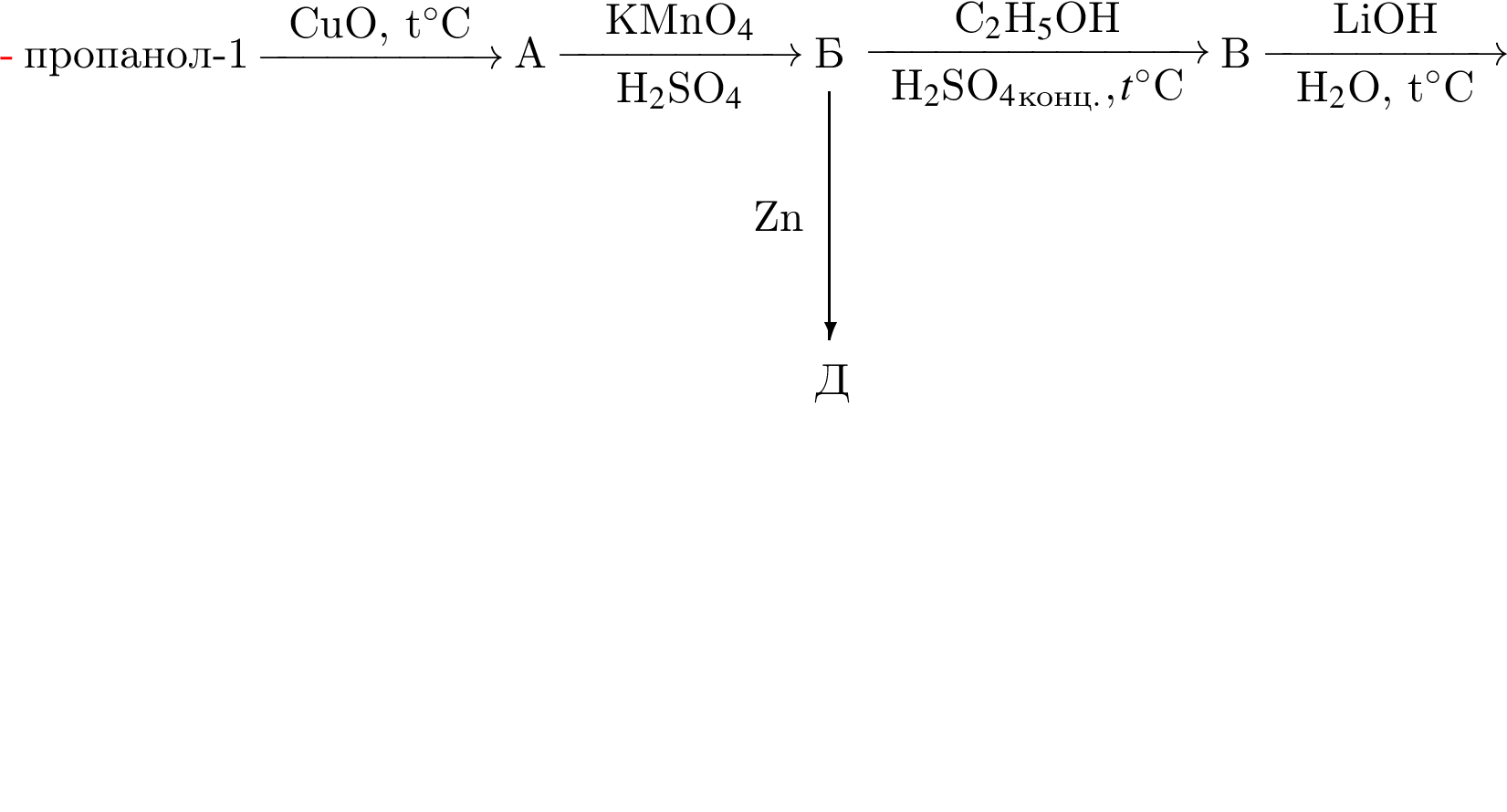
Определите сумму молярных масс (г/моль) органических веществ молекулярного строения А и немолекулярного строения Д и Г, полученных в результате превращений:
Выберите утверждения, характеризующие водород:
1) встречается в виде трех изотопов
2) самый распространенный элемент на Земле
3) в реакции с литием выступает в роли окислителя
4) применяется для восстановления металлов из их оксидов
5) выделяется в виде газа при растворении меди в азотной кислоте
6) в составе хлороводорода может выступать только в роли восстановителя
Ответ запишите в виде последовательности цифр в порядке возрастания, например: 245.
Для получения веществ по схеме превращений

выберите реагенты из предложенных (на стадии 4 прибавляйте газообразное при н. у. вещество):
1) ![]()
2) 
3) ![]()
4) 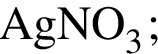
5) ![]()
6) ![]()
7) ![]()
Ответ запишите цифрами в порядке следования превращений, например: 2443. Помните, что один и тот же реагент может использоваться несколько раз или не использоваться вообще.
Насыщенный альдегид, в молекуле которого содержится один атом кислорода, восстановили водородом. Продукт реакции восстановления прореагировал с уксусной кислотой в присутствии серной кислоты. В результате образовалось органическое соединение массой 18,36 г, при взаимодействии которого с избытком раствора гидроксида калия получилось калийсодержащее вещество массой 17,64 г. Определите молярную массу (г/моль) альдегида.
К раствору серной кислоты массой 220 г с массовой долей H2SO4 15% прибавили раствор иодида бария массой 80 г. При этом массовая доля серной кислоты в растворе уменьшилась до 9%. Рассчитайте массовую долю (%) BaI2 в добавленном растворе.
Определите сумму молярных масс (г/моль) азотсодержащих веществ ![]() и
и ![]() образовавшихся в результате превращений, протекающих по схеме
образовавшихся в результате превращений, протекающих по схеме
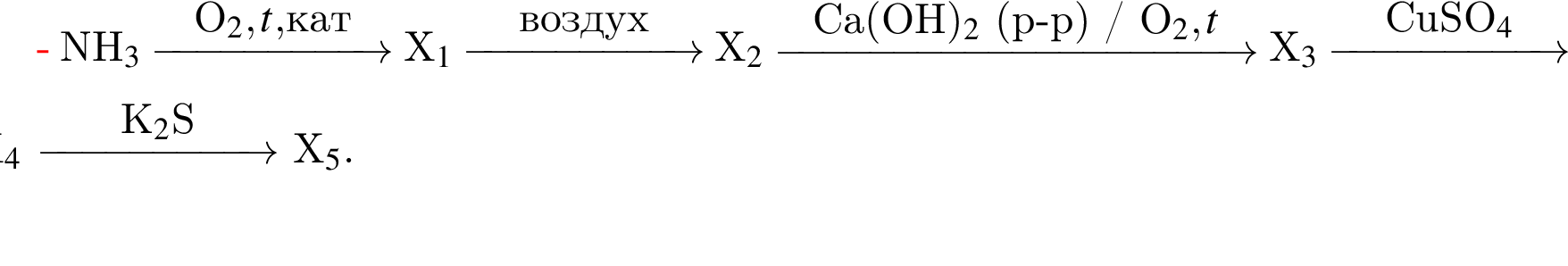
Смесь алкина и сероводорода в мольном отношении 1 : 3 сожгли в избытке кислорода. Продукты сгорания поглотили избытком раствора гидроксида кальция. Действием окислителя на выпавший осадок весь сульфит кальция перевели в сульфат кальция. Масса полученного в результате осадка (сульфат и карбонат кальция) составила 40,4 г. При действии на этот осадок избытка соляной кислоты образуется 4,48 дм3 (н. у.) газа. Укажите молярную массу (г/моль) алкина.
В реактор постоянного объёма поместили смесь кислорода и озона химическим количеством 2 моль. В результате разложения всего озона давление в реакторе увеличилось на 29% (давление измеряли при одинаковой температуре). Вычислите объём (дм3) исходной смеси кислорода и озона (н. у.), необходимой для полного окисления
метана массой 12 г до углекислого газа и воды.
Для анализов смеси хлоридов калия и аммония провели следующие операции. Навеску смеси массой 10г растворили в воде. К полученному раствору прибавили 540г раствора гидроксида калия с массовой долей ![]() 2,8% и нагрели до полного удаления аммиака. В образовавшийся раствор добавили метиловый оранжевый, а затем акуратно прибавляли соляную кислоту, пока среда раствора не стала нейтральной. Объем израсходованной кислоты равен 330см3, концентрация HCl в кислоте 0,5моль/дм3. Вычислите массовую долю(%) хлорида аммония в исходной смеси.
2,8% и нагрели до полного удаления аммиака. В образовавшийся раствор добавили метиловый оранжевый, а затем акуратно прибавляли соляную кислоту, пока среда раствора не стала нейтральной. Объем израсходованной кислоты равен 330см3, концентрация HCl в кислоте 0,5моль/дм3. Вычислите массовую долю(%) хлорида аммония в исходной смеси.
Для корректировки дефицита железа в корм цыпленка бройлера добавляют кристаллогидрат соли железа в расчете 82 мг металла на 1 кг корма. Массовые доли химических элементов в кристаллогидрате составляют: 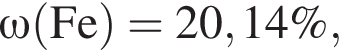
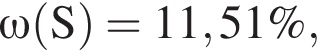
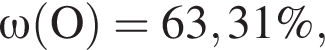
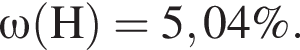 Вычислите массу (мг) кристаллогидрата в 300 г корма.
Вычислите массу (мг) кристаллогидрата в 300 г корма.
Для приготовления сахарного сиропа к порции раствора сахара массой 500 г при температуре 60 °C дополнительно добавили 220 г сахара и тщательно перемешали. При этом 20 г сахара не растворилось. Рассчитайте массу (г) сахара в исходном растворе, если его растворимость при данной температуре равна 300 г в 100 г воды.
К твердой смеси, состоящей из 48 г сульфата магния, 15,3 г мрамора и 48,3 г карбоната калия, добавили избыток дистиллированной воды и перемешали. Полученную суспензию отфильтровали, а образовавшийся на фильтре осадок высушили и взвесили. К отфильтрованному раствору добавили избыток раствора нитрата бария, в результате чего выпал новый осадок. Рассчитайте сумму масс (г) обоих осадков.
В растворе, полученном добавлением азотной кислоты к разбавленной серной кислоте, суммарная молярная концентрация анионов равна 0,009 моль/дм3, а значение pH 2. Считая, что обе кислоты полностью распадаются на ионы, вычислите количество (моль) азотной кислоты в этом растворе объемом 1 м3.

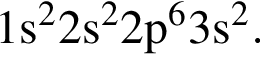 То есть все электроны спарены.
То есть все электроны спарены.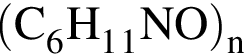
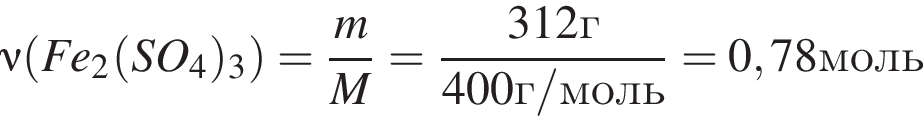
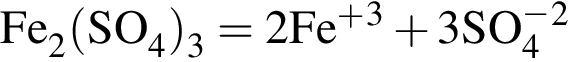
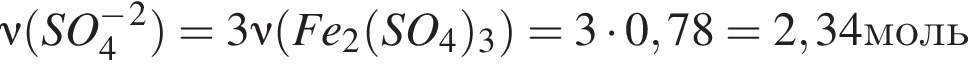
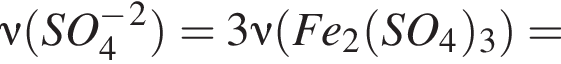

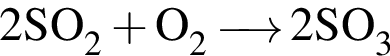 получается кислотный оксид.
получается кислотный оксид.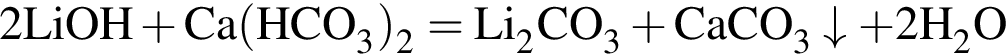
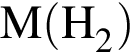 /
/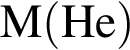 =2/4 = 0,5.
=2/4 = 0,5.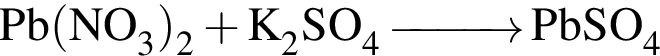 ↓
↓
 ↓
↓
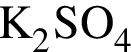 с
с 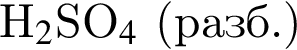 и
и 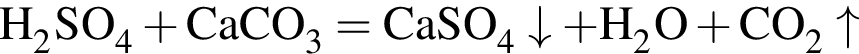
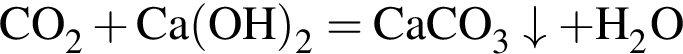
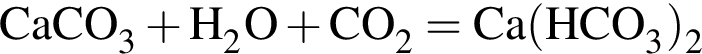
 .
.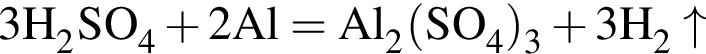
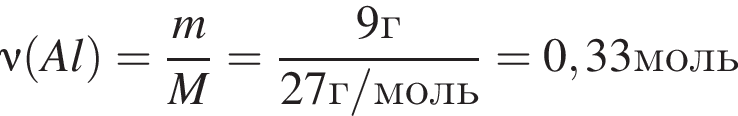
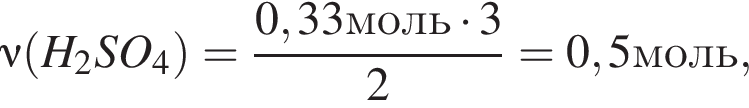 откуда
откуда 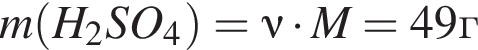 и
и 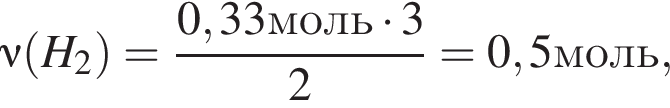 откуда
откуда 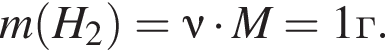
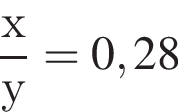
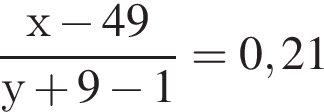
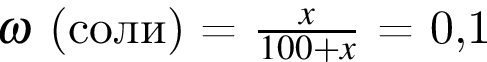
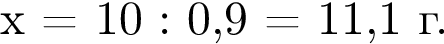
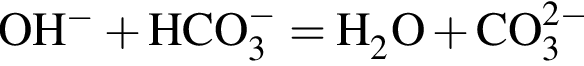
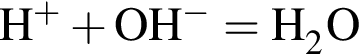
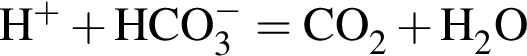
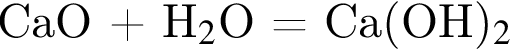
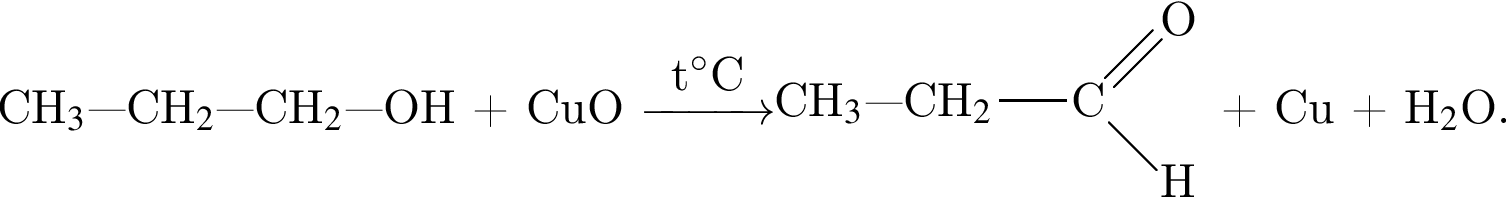



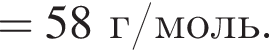
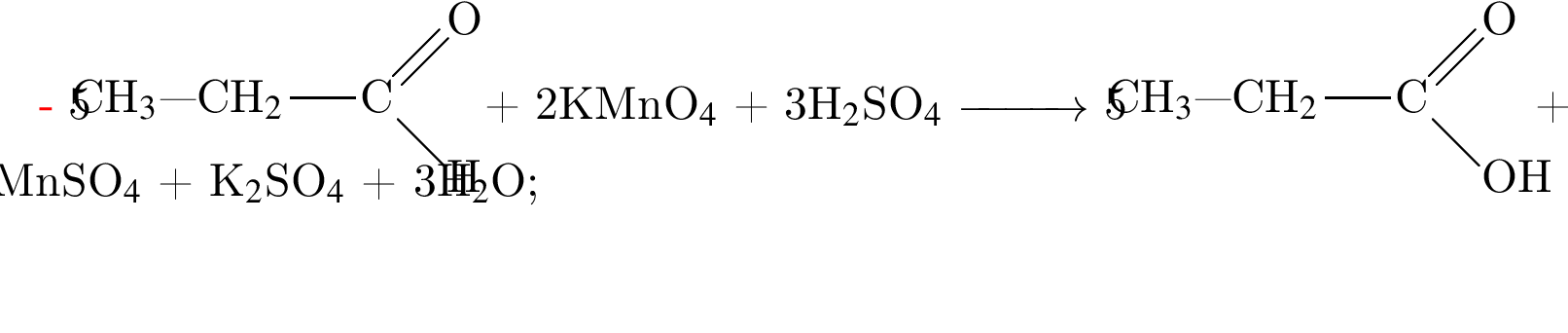
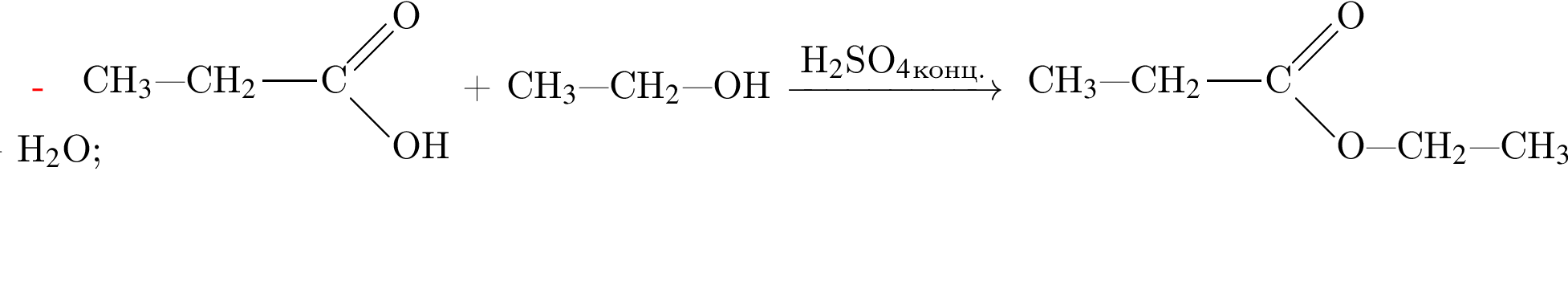
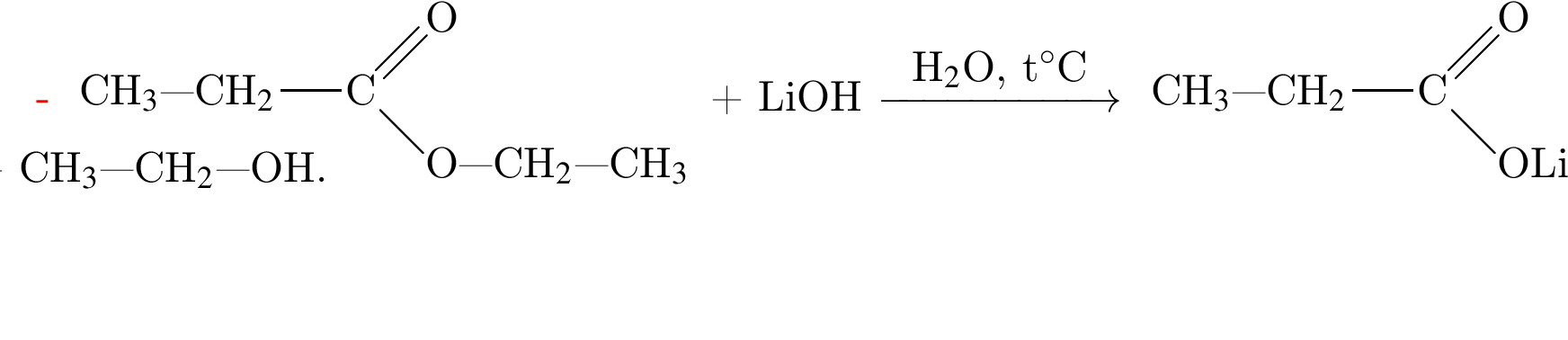
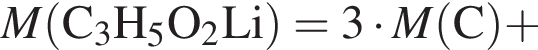
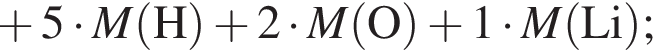
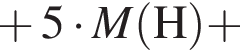
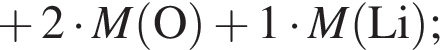
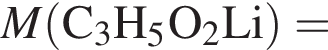

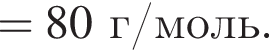
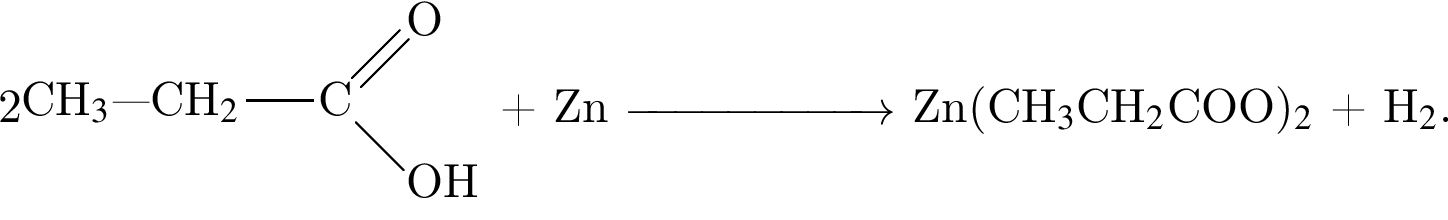

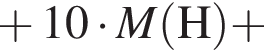



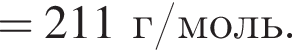
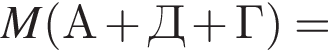
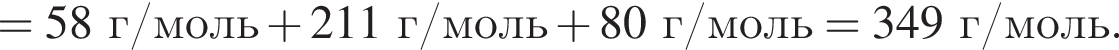
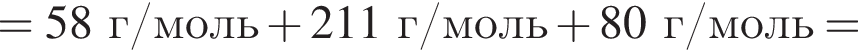
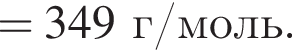
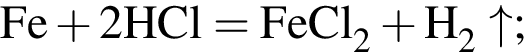

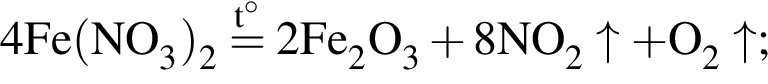
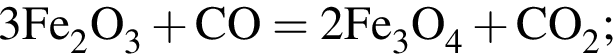
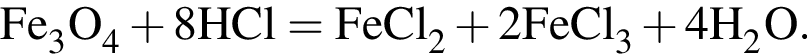
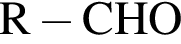 +
+ 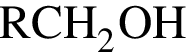
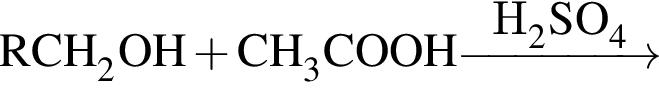
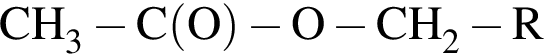 (m = 18,36 г) +
(m = 18,36 г) + 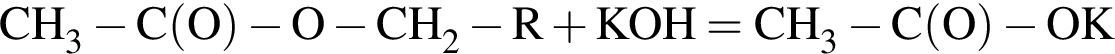 (m = 17,64 г) +
(m = 17,64 г) + 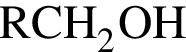 ;
;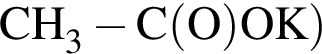 = 17.64/98 = 0.18 моль,
= 17.64/98 = 0.18 моль, 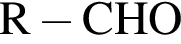 ) = 102-44 = 58 г/моль
) = 102-44 = 58 г/моль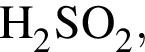 Broken TeX Broken TeX 80 г.
Broken TeX Broken TeX 80 г. 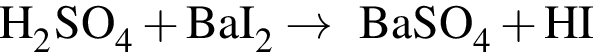
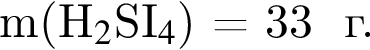
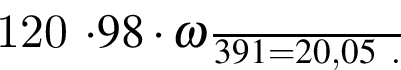
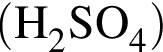
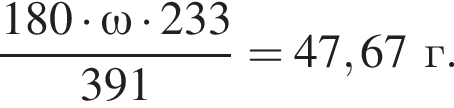
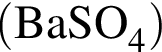
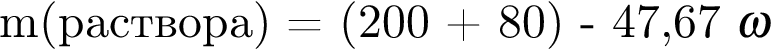
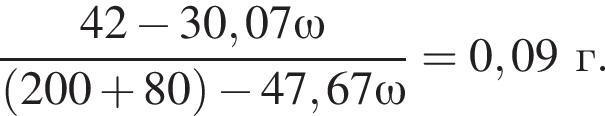
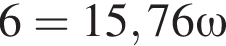

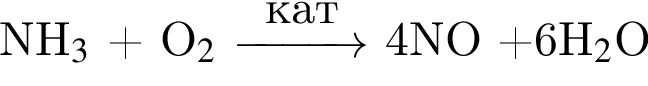
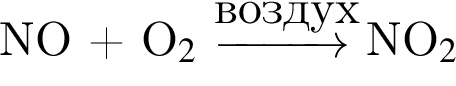
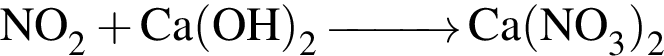

 ↓
↓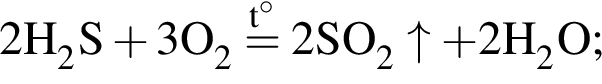
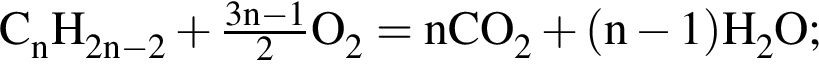
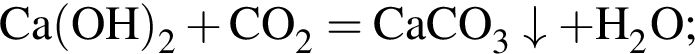
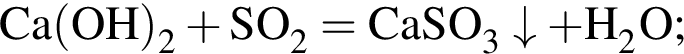
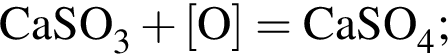
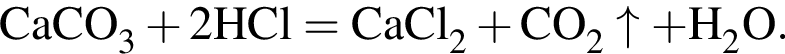
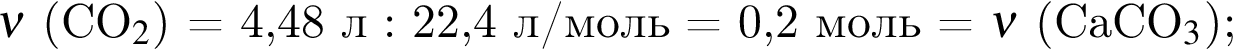
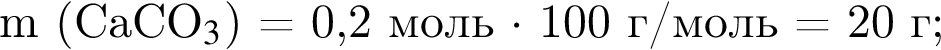
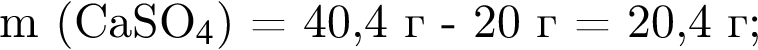
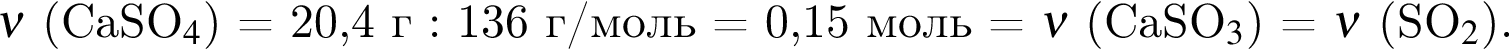
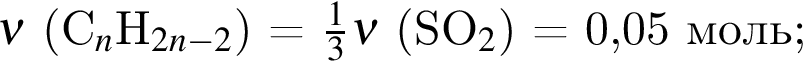
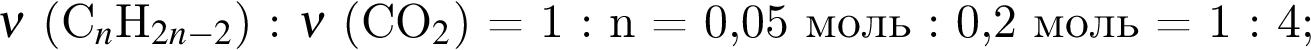



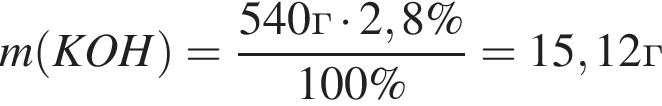
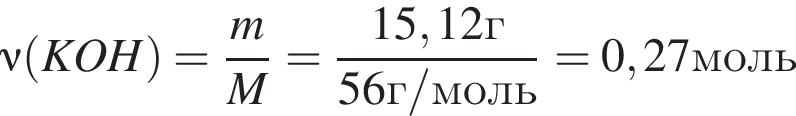
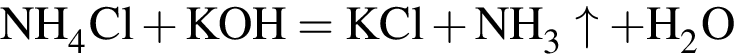 , оставшийся
, оставшийся 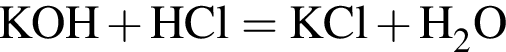
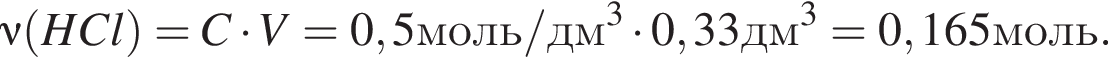

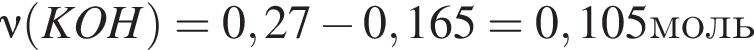 прореагировало с
прореагировало с 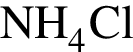 .
. Найдем массу хлорида аммония:
Найдем массу хлорида аммония: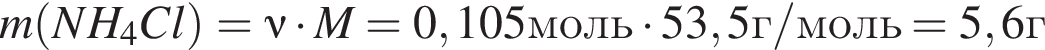

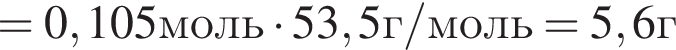
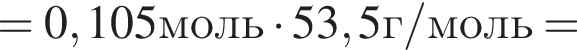
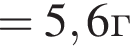
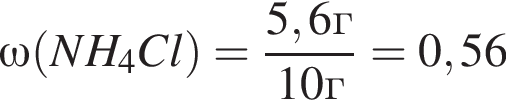 (56%)
(56%)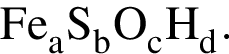 Найдем соотношение атомов железа, серы, кислорода и водорода в соединении:
Найдем соотношение атомов железа, серы, кислорода и водорода в соединении: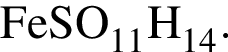 Это соответствует формуле гептагидрата сульфата железа(II) —
Это соответствует формуле гептагидрата сульфата железа(II) — 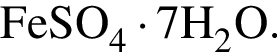
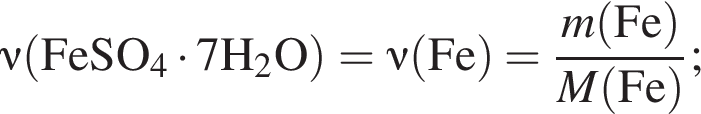
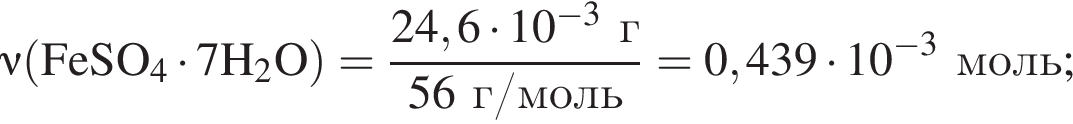
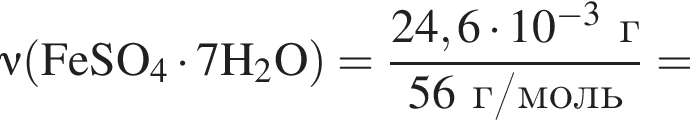
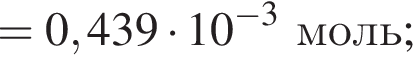
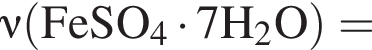
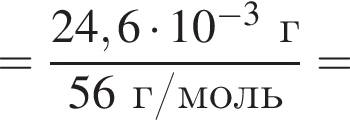
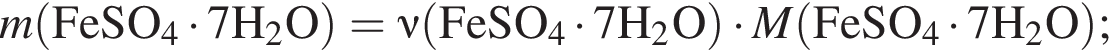
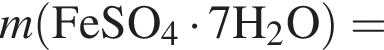
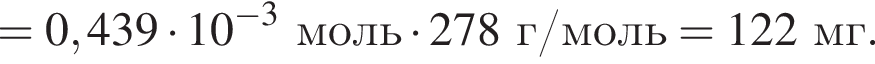

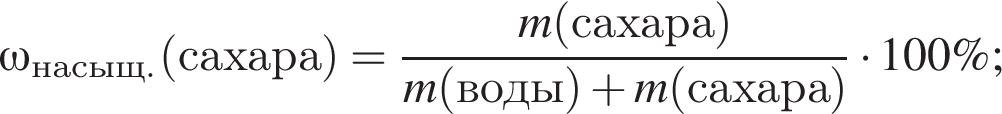
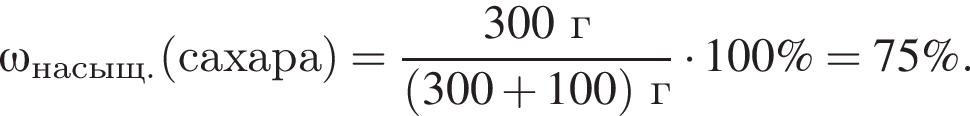


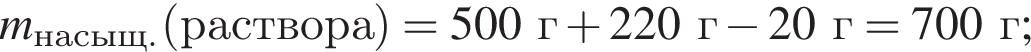

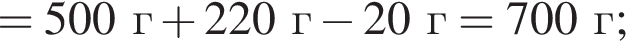



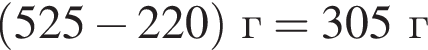 сахара. При этом, 20 г не растворилось. Следовательно, в исходном растворе содержалось
сахара. При этом, 20 г не растворилось. Следовательно, в исходном растворе содержалось 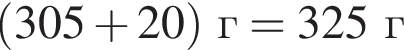 сахара.
сахара.
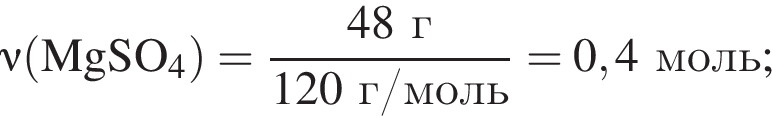
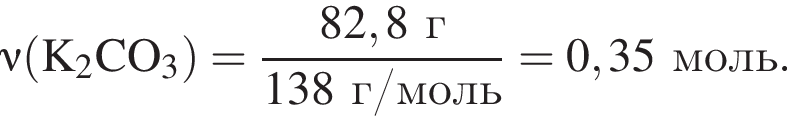
 Найдем его массу:
Найдем его массу:

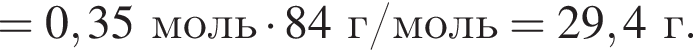
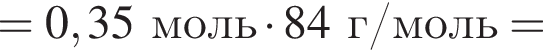
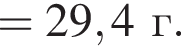
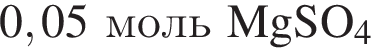 и
и  При добавлении избытка нитрата бария происходят следующие реакции:
При добавлении избытка нитрата бария происходят следующие реакции:


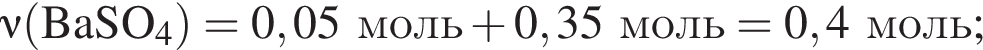

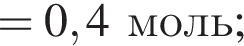


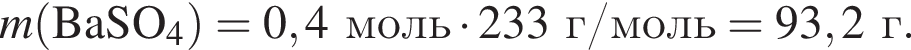

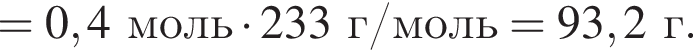
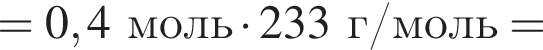
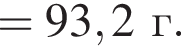



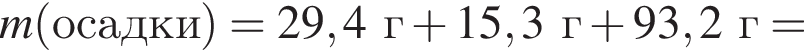
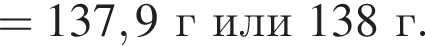
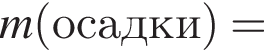
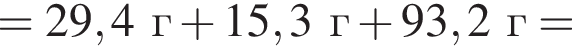
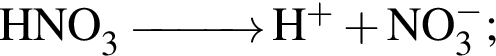
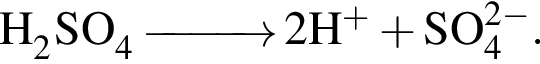

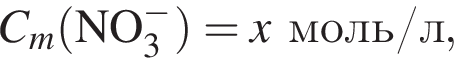 а
а 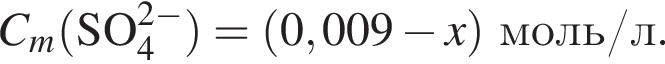 Так как
Так как  то
то 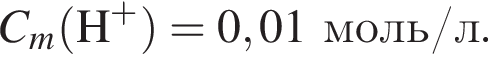 Исходя из условия электронейтральности получим следующее уравнение и решим его:
Исходя из условия электронейтральности получим следующее уравнение и решим его:  откуда
откуда 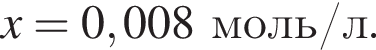 Значит,
Значит,